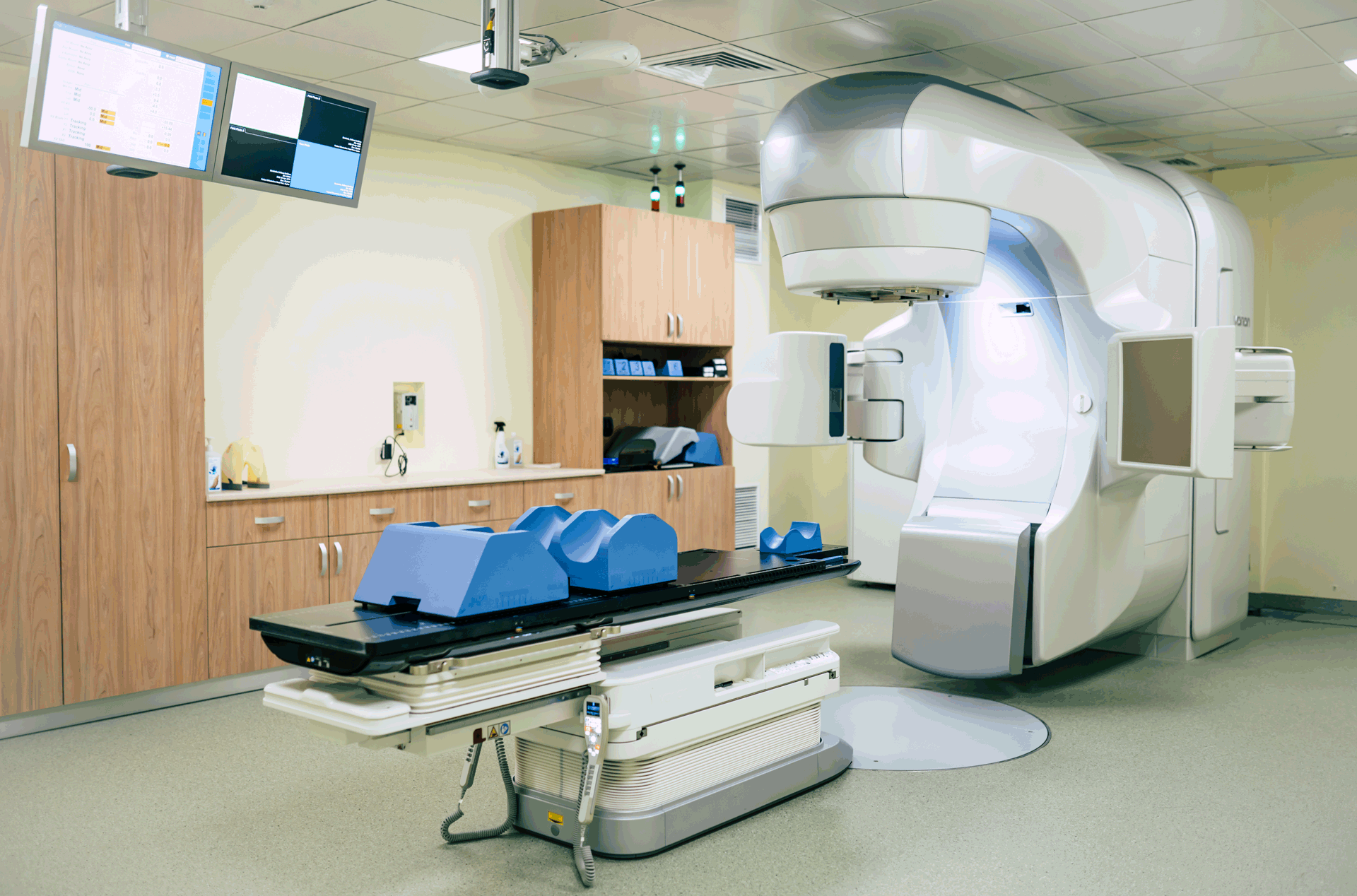
La radiothérapie est un pilier du traitement médical des tumeurs du système nerveux central. Etant donné que de plus en plus de patients présentent un allongement de leur durée de vie après le traitement initial, gain chiffré en années pour un grand nombre, les effets secondaires tardifs de la radiothérapie sont et resteront un élément essentiel de la réflexion des oncologues-radiothérapeutes, avec celui de l’efficacité des traitements. En réponse à cette attention, de nouvelles approches ont été développées, que ce soit en termes de qualité de délivrance du rayonnement, de nature des particules ionisantes utilisées, et de la place de la radiothérapie dans les stratégies de traitement. Pour ce faire, des essais cliniques sont en cours afin de répondre spécifiquement à ces questions.
Les avancées technologiques des dernières années, telles que la mécanique, l’informatique, l’imagerie, la radiophysique ont permis de déboucher sur une ère de la radiothérapie de très haute précision, diminuant ainsi l’exposition des tissus sains.
Quelques idées simples sur la radiothérapie en neuro-oncologie
Les radiations ionisantes peuvent être délivrées de différentes façons ; toutefois la radiothérapie externe fractionnée est la méthode la plus fréquemment utilisée. Un patient reçoit typiquement une séance quotidienne de 15 minutes, 5 jours par semaine, sur 3 à 7 semaines.
Le nombre de séances est déterminé par l’oncologue-radiothérapeute en fonction de plusieurs critères, en particulier l’état général du patient, la pathologie prise en charge, la localisation et le volume de la tumeur. Les patients doivent être traités chaque jour dans une position spécifique et reproductible. Cet objectif est atteint grâce à l’utilisation de masques et de matelas de contention, confectionnés avant la réalisation d’un scanner en position de traitement.
Moins de risques de lésions
Les rayonnements utilisés sont majoritairement des photons (rayons X) produits par un accélérateur linéaire de particules. Les photons sont délivrés par des champs d’irradiation dirigés vers la tumeur cible. La dose absorbée par les tissus est mesurée en Gray (Gy) et pour les adultes, cette dose prescrite est de 23,4 à 60 Gy selon la pathologie traitée. Cette dose est calculée avec une très haute précision grâce à l’utilisation de logiciels puissants et rapides, représentant une représentation graphique dans les trois dimensions de la distribution de la dose en regard des structures d’intérêt. Les photons déposent leur énergie dans les cellules, causant ainsi des dommages de l’ADN. Ces dommages s’accumulant provoquent la mort des cellules. Les cellules tumorales ont perdu la capacité de réparer les lésions de l’ADN alors que les cellules saines la conservent, tout du moins partiellement. La radiothérapie délivrée sur plusieurs semaines permet donc aux cellules saines de réparer partiellement leur ADN après chaque séance ce qui n’est pas le cas des cellules tumorales. Ceci est appelé : effet différentiel. Le défaut de réparation des tissus sains est un élément expliquant le risque de toxicité. Diminuer l’exposition des tissus normaux aux radiations est un objectif-clé pour le radiothérapeute. On rappelle que le niveau de sécurité de la radiothérapie s’est renforcé ces dernières années avec un contrôle quotidien des machines, des maintenances régulières, des mesures de la dose « in vivo » à chaque début de traitement pour tous les patients, une philosophie digne de l’aviation avec une analyse de tous les évènements à priori (retours d’expérience afin de corriger les éventuels dysfonctionnements).
La radiothérapie guidée par l’imagerie
La radiothérapie guidée par l’imagerie s’est largement développée ces dernières années. L’adjonction de cette technique permet de repérer avec une plus grande sélectivité et précision les tumeurs et les tissus normaux avant et pendant l’irradiation. Avant le traitement, pour le repérage des cibles tumorales, l’utilisation de puissants logiciels informatiques permet de fusionner plusieurs modalités d’imagerie, comme le scanner, l’imagerie par résonance magnétique (IRM) avec ses différentes séquences, l’imagerie nucléaire avec différents marqueurs biologiques. Ceci permet d’obtenir une imagerie morphologique et métabolique, source d’une meilleure définition de la tumeur et des organes à risque. Pendant le traitement lui-même, des appareils d’imagerie intégrés de type radiographie conventionnelle, scannographie, IRM (accélérateur avec IRM embarquée sur le groupe hospitalier Pitié-Salpêtrière en 2019) sont utilisés pour contrôler la position du patient et adapter chaque jour la position des faisceaux aux mouvements et aux changements de forme des tumeurs ou des organes sains. On parle de radiothérapie adaptative. Des logiciels assistent les radiothérapeutes et les radiophysiciens pour comparer les images acquises pendant la radiothérapie. Ceci est possible par un repositionnement immédiat du patient via des déplacements de la table de traitement. Avant cette ère de l’imagerie, il était nécessaire d’inclure une marge non négligeable de tissus sains autour de la tumeur pour compenser la relative incertitude. Aujourd’hui, ces marges sont réduites à quelques millimètres.
Techniques de radiothérapie
L’utilisation de la radiothérapie guidée par l’image est associée à des techniques d’irradiation hautement conformationnelle comme la radiothérapie par modulation d’intensité (RCMI) par photons, la protonthérapie et la radiothérapie en conditions stéréotaxiques en une fraction (appelée radiochirurgie) ou plusieurs fractions.
La RCMI constitue l’un des progrès techniques majeurs accomplis en Oncologie-Radiothérapie. La distribution de dose est répartie de façon hétérogène afin d’incrémenter la dose au niveau de la tumeur et de réduire l’exposition des tissus sains aux rayonnements ionisants. Plusieurs approches de RCMI ont été décrites : faisceaux mobiles (arcthérapie) ou fixes, tomothérapie hélicoïdale. La distribution de dose est comme « sculptée » à la forme de la tumeur tout en minimisant la dose dans les tissus sains de voisinage.
Protonthérapie et Gamma knife
L’utilisation des protons en médecine n’est pas récente mais cette technique est restée confidentielle de par le coût et l’encombrement de ces équipements. L’industrialisation des appareils a permis le développement des centres à travers le monde, avec trois centres en activité en France à la date de Août 2018 (Orsay, Nice, Caen). L’avantage des protons provient de la répartition de la dose dans les tissus sous forme d’un pic (Bragg) permettant de réduire la dose à zéro dans les premiers centimètres autour de la tumeur. En un mot, le « bain » de dose dans le cerveau est réduit de un tiers tout en assurant un traitement de qualité de la tumeur. Cet avantage est majeur en pédiatrie en raison de la sensibilité aux rayons des tissus en pleine croissance. L’avenir de cette technique dépendra des résultats des études cliniques, des développements techniques et des coûts. Autant la RCMI a déjà fait ses preuves en neuro-oncologie pour un certain nombre d’indications, autant la place de la protonthérapie doit être définie même si de toutes premières études majeures pressentent son intérêt, tout du moins en neuro-oncologie pédiatrique.
La radiothérapie en conditions stéréotaxiques utilise des mini-faisceaux délivrant de fortes doses dans de petits volumes en une à dix fractions. Les machines utilisées sont le Gamma-Knife (groupe hospitalier Pitié-Salpêtrière), le Cyberknife et les accélérateurs linéaires dédiés. Cette technique peut parfois même remplacer la chirurgie, comme par exemple pour les métastases cérébrales ou certaines tumeurs bénignes (méningiomes, par exemple). A ce jour, en neuro-oncologie, aucune étude clinique n’a mis en évidence de supériorité significative d’une technique de RCMI ou de radiothérapie stéréotaxique comparée à une autre, aussi bien en termes d’efficacité que de toxicité.
Traitements associés
Ces dernières années, le développement de nouvelles molécules (thérapies ciblées, immunothérapie) en oncologie est majeur de par les progrès de la biologie moléculaire. De nombreux essais sont en cours afin d’évaluer la tolérance et l’efficacité des associations de la radiothérapie avec les thérapies ciblées. Chacune des techniques de radiothérapie décrites ci-dessus est concernée par ces essais cliniques.
En neuro-oncologie, on retiendra que les avancées biologiques et techniques ont ouvert des portes thérapeutiques encore inimaginables il y a quelques années. Et inversement, les progrès obtenus au quotidien pour nos patients stimuleront nos chercheurs à s’engager sur des voies nouvelles, forts de leurs découvertes et leur rôle dans les soins.

